PEVOsq: Pembrolizumab + Vorinostat en carcinomas de células escamosas recurrentes/metastásicos
Fecha
31 jul 2025
Resumen
Un ensayo clínico fase II ha evaluado la combinación de pembrolizumab y vorinostat en diversos carcinomas de células escamosas, revelando una actividad antitumoral prometedora en subtipos específicos y destacando potenciales biomarcadores predictivos de respuesta.
Autor/a

Diana Darriba
Los carcinomas de células escamosas (SCC) se encuentran entre los tumores sólidos más comunes, afectando a pulmones, cérvix, cabeza y cuello (HNSCC), así como a las regiones anal, vulvar/vaginal y peniana. A pesar de la aparición de las inmunoterapias, los SCC recurrentes o metastásicos suelen tener un pronóstico desfavorable y opciones terapéuticas limitadas. Aunque los inhibidores de puntos de control inmunitario (ICI), como el pembrolizumab, son tratamientos estándar, sólo una minoría de pacientes logra respuestas duraderas (ORR del 15% al 24%). La modulación epigenética juega un papel clave en la evasión inmunitaria tumoral y la resistencia a los ICI. El vorinostat, un "epidrug" que inhibe las HDACs, ha demostrado efectos sinérgicos con los ICI en estudios preclínicos. El estudio PEVOsq se propuso investigar esta combinación innovadora y buscar nuevos biomarcadores genómicos asociados a la respuesta.
🧪 ¿Cuál fue el diseño experimental?
PEVOsq (NCT04357873) fue un ensayo fase II, abierto, no aleatorizado y multicéntrico, diseñado en formato "basket", lo que permitió incluir pacientes con SCC recurrentes o metastásicos de diversas localizaciones primarias, como anal, HNSCC, cervical, vulvar/vaginal y peniano.
Se reclutaron 112 pacientes sin exposición previa a ICI entre octubre de 2020 y mayo de 2022. La población de eficacia incluyó a 107 pacientes, y la población de seguridad a 111.
Los pacientes recibieron pembrolizumab 200 mg por vía intravenosa cada 3 semanas, en combinación con vorinostat 400 mg por vía oral una vez al día con alimentos. El tratamiento continuó hasta la progresión de la enfermedad, toxicidad inaceptable o decisión del paciente.
El objetivo principal fue evaluar la tasa de respuesta objetiva (ORR) por cohorte, según la evaluación del investigador. Los objetivos secundarios incluyeron la seguridad, la supervivencia libre de progresión (PFS), la supervivencia global (OS) y la duración de la respuesta (DOR). La evaluación de la eficacia se realizó mediante imágenes radiológicas cada 6 semanas según RECIST 1.1. La seguridad se evaluó según CTCAE v5.0. Además, se realizaron análisis traslacionales para identificar biomarcadores como la expresión de PD-L1 (CPS, TPS), el estado de HPV y la carga mutacional tumoral (TMB) mediante secuenciación de exoma completo (WES).
📈 ¿Qué encontraron?
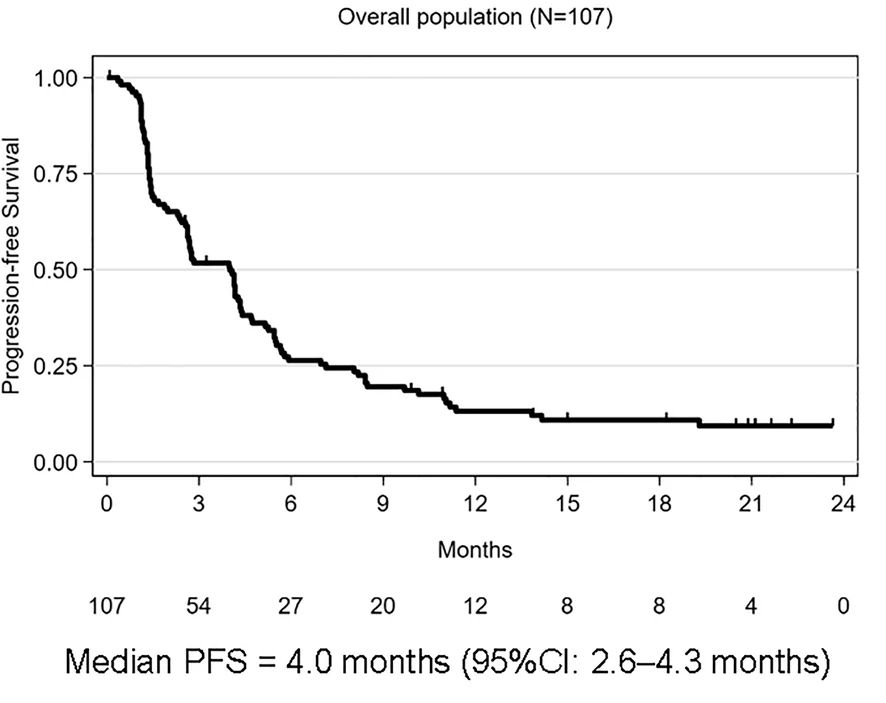
En cuanto a la eficacia y la actividad tumoral, los resultados por cohorte fueron los siguientes, donde se alcanzó el objetivo primario en los carcinomas escamosos de cérvix, ano y vulva/vagina:
cohorte | ORR | mediana PFS | mediana OS | mediana DoR |
Total | 26% (IC 95%: 18-36) | 4,0 meses | 11,1 meses | 9,7 meses |
Cérvix | 39% (IC 95%: 20-62) | 4,2 meses | 10,3 meses | |
Ano | 31% (IC 95%: 15-51) | 5,8 meses | 18,8 meses | |
Vulva/vagina | 19% (IC 95%: 4-46) | 1,3 meses | 17,5 meses | |
Cabeza y cuello | 19% (IC 95%: 6,6-39) | 4,1 meses | 9,2 meses | |
Pene | 18% (IC 95%: 2,3-52) | 2,4 meses | 4,4 meses |
⛑️ Acerca de la seguridad:
101 de 111 pacientes (91%) desarrollaron al menos un evento adverso relacionado con el tratamiento (TRAE) y el 39% de los pacientes experimentó al menos un TRAE de grado 3, y el 5,4% al menos uno de grado 4. Los más frecuentes de cualquier grado fueron:
Astenia (61%)
Náuseas (51%)
Diarrea (37%)
Disminución del apetito (37%)
Anemia (41%)
Trombocitopenia (36%)
La mayoría de los TRAEs graves (grado ≥ 3) se relacionaron con vorinostat, lo que llevó a modificaciones de dosis o interrupciones en el 66% de los pacientes. No se registraron muertes tóxicas durante el estudio.
🧬 Biomarcadores y resultados clínicos:
Estado de HPV: Los SCCs HPV-positivos mostraron ORRs más altas (34%) que los HPV-negativos (16%) (P=0,03). También se asoció con una PFS y OS más prolongadas (P<0,001 y P<0,05, respectivamente).
PD-L1 CPS: Un CPS más alto se correlacionó con una mejor ORR.
TMB: Una TMB alta se asoció positivamente con la ORR (58% vs. 20% para TMB baja; P=0,01) y con una PFS y OS más prolongadas.
Alteraciones Genómicas (WES): Alteraciones en RAD51, NOTCH1 y B2M se asociaron con una PFS más larga (P<0,05). Las alteraciones en PIK3CA se vincularon con una OS más prolongada (P<0,05). Por el contrario, las mutaciones en TP53 se asociaron con una peor OS (P<0,05).
📍 En resumen...
El ensayo PEVOsq demuestra una actividad antitumoral prometedora de la combinación de pembrolizumab + vorinostat en pacientes con SCC recurrentes o metastásicos, especialmente en los cánceres de cérvix, ano y vulva/vagina. Estos resultados representan una mejora notable en comparación con las terapias con ICI en monoterapia previamente documentadas para estas localizaciones.
Aunque el perfil de seguridad general fue manejable, la toxicidad relacionada con vorinostat fue sustancial y requirió ajustes de dosis en un porcentaje significativo de pacientes. La identificación de biomarcadores como la positividad de PD-L1 y HPV, así como una alta TMB, junto con alteraciones genómicas específicas como las de RAD51, NOTCH1 y PIK3CA, sugieren un potencial para seleccionar mejor a los pacientes que se beneficiarían de esta combinación terapéutica.
Las limitaciones del diseño "basket" del estudio, que incluyen cohortes pequeñas, y la naturaleza univariante de algunos análisis de biomarcadores, exigen cautela en la interpretación y la necesidad de validación en ensayos futuros con poblaciones más amplias. No obstante, este estudio pionero destaca una estrategia terapéutica innovadora y la importancia de la genómica para guiar las decisiones de tratamiento en SCC complejos y heterogéneos.
Noticias Destacadas
SARCOMA
NCT04200443: Cabozantinib + temozolomida en leiomiosarcoma y otros sarcomas de tejidos blandos

HEMATOONCO
inMIND: tafasitamab + lenalidomida y rituximab en linfoma folicular en recaída o refractario
.png)